On jo kauan tiedetty, että kaikilla molekyyleillä on kaksi yhtä suurta ja vastakkaista varausta, jotka erotetaan tietyllä etäisyydellä. Tällaisten polaarimolekyylien tapauksessa negatiivisen varauksen keskipiste ei ole sama kuin positiivisen varauksen keskipiste. Napaisuuden laajuus tällaisissa kovalenttisissa molekyyleissä voidaan kuvata termillä Dipolimomenti, joka on olennaisesti napaisuuden mitta polaarisessa kovalenttisessa sidoksessa.
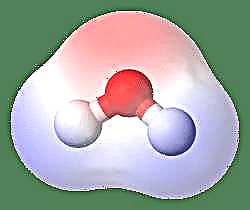
Yksinkertaisin esimerkki dipolista on vesimolekyyli. Vesimolekyyli on polaarinen johtuen sen elektronien epätasaisesta jakautumisesta “taivutettuun” rakenteeseen. Vesimolekyyli muodostaa kulman vetyatomilla kärjissä ja happea kärjessä. Koska hapen elektronegatiivisuus on suurempi kuin vedyn, molekyylin sillä puolella, jossa on happiatomi, on osittainen negatiivinen varaus, kun taas vedyllä, jonka keskellä on osittainen positiivinen varaus. Tämän vuoksi dipolimomentin suunta osoittaa happea kohti.
Fysiikan kielellä sähköinen dipolimomentti on positiivisten ja negatiivisten sähköisten varausten erottumisen mittaus varausjärjestelmässä, toisin sanoen varausjärjestelmän kokonaisnapaisuuden mitta - ts. Molekyylien sähkövarauksen erottelu, joka johtaa dipoliin. Matemaattisesti ja yksinkertaisessa tapauksessa kahden pistevarauksen, joista toisella on varaus + q ja toisella, jolla on varaus? Q, sähköinen dipolimomentti p voidaan ilmaista seuraavasti: p = qd, missä d on siirtymävektori, joka osoittaa negatiivisesta varauksesta kohtaan positiivinen varaus. Siten sähköinen dipolimomenttivektori p osoittaa negatiivisesta varauksesta positiiviseen varaukseen.
Toinen tapa tarkastella sitä on esittää dipolimomenttia kreikkalaisella kirjaimella m, m = ed, missä e on sähkövaraus ja d on etäisyys etäisyydelle. Se ilmaistaan Debye-yksiköinä ja kirjoitetaan D: nä (missä 1 Debye = 1 x 10-18e.s.u cm). Dipolimomentti on vektorimäärä, ja sitä edustaa sen vuoksi pieni nuoli, jossa häntä on positiivisessa keskuksessa ja pää osoittaa kohti negatiivista keskustaa. Vesimolekyylin tapauksessa dipolimomentti on 1,85 D, kun taas suolahapon molekyyli on 1,03 D ja sitä voidaan esittää seuraavasti:
Olemme kirjoittaneet monia artikkeleita dipolihetkestä Space Magazine -lehteen. Tässä on artikkeli siitä, mistä vedestä tehdään, ja tässä artikkeli molekyyleistä.
Jos haluat lisätietoja dipolihetkestä, katso nämä artikkelit Hyperphysics and Science Daily -sivustolta.
Olemme myös nauhoittaneet koko jakson tähtitiede-näyttelijöistä, jotka käsittelevät molekyylejä avaruudessa. Kuuntele täällä, jakso 116: Molecules in Space.
Lähteet:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule